Мочевой пузырь неправильной формы может быть результатом различных медицинских состояний, таких как врожденные аномалии, травмы или опухоли. Эти изменения могут влиять на функцию органа, приводя к затруднениям с мочеиспусканием и повышенному риску инфекций мочевых путей.
Для диагностики данной патологии обычно используются ультразвуковые исследования и другие визуализирующие методы. Лечение зависит от причины деформации и может включать медикаментозную терапию, хирургическое вмешательство или наблюдение в динамике.
Рубцовая деформация шейки мочевого пузыря
Рубцовая деформация шейки мочевого пузыря может возникнуть в результате хирургических операций. Наряду с этим, причиной могут стать воспалительные заболевания, такие как простатит или цистит, а также недостаток пластичности слизистой оболочки. Эта патология чаще всего наблюдается у мужчин старше 45 лет, в результате чего образуется плотная соединительная ткань.
Процесс деформации шейки мочевого пузыря происходит поэтапно. На первом этапе наблюдаются изменения клеток в соединительной ткани, которые производят эластин и коллаген. Увеличивается количество коллагена, что приводит к образованию рубцов на шейке пузыря. Постепенно просвет этого отдела уменьшается, и в некоторых случаях может полностью закрыться.
Симптомы
К основным признакам деформации шейки мочевого пузыря относятся:
- Проблемы с оттоком мочи, которые со временем ухудшаются, что приводит к невозможности её выделения.
- Слабая струя мочи, периодические перерывы при мочеиспускании.
- Болевые ощущения во время мочеиспускания.
- Повышение температуры тела, которое может возникнуть в случае воспалительного процесса.
Важно! Следует обратиться к врачу на ранних стадияхрубцовой деформации. Это поможет предотвратить серьезные осложнения, среди которых можно выделить гидронефроз, пиелонефрит и почечную недостаточность, которые представляют опасность для здоровья и жизни пациента.
Причины аномалий развития
Не существует четко определенных причин возникновения подобных аномалий. Они, как правило, связаны с нарушениями в мочеполовой системе в процессе эмбрионального развития. К факторам риска относятся:
- наследственная предрасположенность;
- негативные привычки матери (курение, алкоголь) во время беременности;
- вредные условия труда матери;
- травмы плода в утробе;
- прием тератогенных препаратов беременной женщиной.
Агенезия мочевого пузыря
Полное отсутствие мочевого пузыря — это редкое явление, чаще всего сочетанное с другими несовместимыми с жизнью отклонениями. Поэтому симптомы агенезии, как правило, не наблюдаются. Такие новорожденные могут либо родиться мертвыми, либо скончаться в первый год жизни из-за нарушения основных функций организма.
Агенезия может быть как истинной, так и ложной. При истинной агенезии есть два отдельных пузыря, в каждый из которых открывается мочеточник. Обычно при этом также наблюдается дублирование мочеиспускательного канала, а одним из главных симптомов данного состояния является недержание мочи.
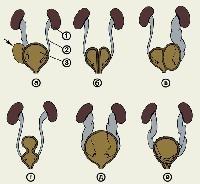
При ложном удвоении есть одно общее устье и мочеиспускательный канал. В некоторых случаях может присутствовать перегородка внутри пузыря, что приводит к нарушению мочеиспускания, задержке мочи, хроническому воспалению и прочим симптомам, которые зависят от размеров перегородки и наличия дополнительных аномалий.
Клинические проявления и осложнения рубцовой деформации шейки мочевого пузыря
Деформация шейки мочевого пузыря развивается поэтапно. Первым делом происходит пролиферация клеток соединительной ткани, которые вырабатывают предшественники коллагена и эластина, что усиливает выработку коллагена. Однако в условиях воспалений или ишемии увеличивается избыточное количество соединительной ткани с преобладанием волокон над клеточными элементами. В результате шейка пузыря подвергается рубцеванию, и её просвет сужается или может полностью закрываться. Это приводит к следующим клиническим проявлениям:
- Проблемы с оттоком мочи, прогрессирующие до полной задержки;
- Трудности при мочеиспускании, слабая струя или её прерывание;
- Ощущение неполного опорожнения мочевого пузыря;
- Болезненные ощущения во время мочеиспускания;
- Повышение температуры тела при наличии воспалительного процесса.
Своевременное обращение за помощью к урологу имеет большое значение, так как это может предотвратить ряд серьезных осложнений. Дело в том, что затрудненный вывод мочи из-за деформации приводит к накоплению остаточной мочи, что, в свою очередь, может вызвать расширение мочеточников и лоханок почек, развивая гидронефроз и почечную недостаточность. Если лечение не начато на этой стадии, вероятно развитие пиелонефрита.
Нейрогенный мочевой пузырь
Нейрогенный мочевой пузырь представляет собой дисфункцию мочевого органа, вызванную неврологическими расстройствами, включая аномалии спинного мозга или центральной нервной системы (такие как расщелина позвоночника, детский церебральный паралич), травмы или последствия хирургического вмешательства на органах малого таза.
Нейрогенный мочевой пузырь может быть вялым, спастическим или комбинированным. Вялый пузырь имеет большой объем с низким давлением и минимальным количеством сокращений. Спастический мочевой пузырь характеризуется нормальным или малым объемом с высоким давлением и непроизвольными сокращениями. Хронически повышенное давление может привести к повреждению почек, даже без наличия инфекции или рефлюкса.
Клинические проявления включают рецидивирующие инфекции мочевых путей, задержку или недержание мочи, образование камней в пузыре и возможную почечную недостаточность.
Неврологические нарушения, лежащие в основе, обычно легко выявляемы. Оценивается остаточный объем мочи после мочеиспускания, проводятся УЗИ почек для диагностики гидронефроза, а также проверяется уровень креатинина или цистатина С в крови для оценки функции почек. Уродинамические исследования часто используются для подтверждения диагноза, мониторинга работы и давления в мочевом пузыре.
Цели лечения пациентов включают снижение риска инфекций, поддержание необходимого давления и резервуара мочевого пузыря, эффективное опорожнение и достижение способности контролировать мочеиспускание. Лечение нейрогенного мочевого пузыря может включать медикаментозную терапию, асептическую интермиттирующую катетеризацию и/или хирургические методы.
Справочные материалы по нейрогенному мочевому пузырю
- Ginsberg DA, Boone TB, Cameron AP, et al. The AUA/SUFU Guideline on Adult Neurogenic Lower Urinary Tract Dysfunction: Diagnosis and Evaluation. J Urol. 2021;206(5):1097-1105.
- Gamé X, Mouracade P, Chartier-Kastler E, et al. Botulinum toxin-A (Botox) intradetrusor injections in children with neurogenic detrusor overactivity/neurogenic overactive bladder: a systematic literature review. J Pediatr Urol. 2009;5(3):156-164.
Результаты
При проведении УЗИ был обнаружен один живой плод женского пола с головным предлежанием. Гестационный срок составил 34,4 недели. Фетометрические параметры плода соответствовали данному сроку. Патологических изменений в плаценте и околоплодных водах не выявлено. Мочевой пузырь в нормальном расположении не визуализировался.
В нижних отделах передней брюшной стенки в надлобковой области было замечено эхогенное образование размером 30x28x25 мм. Наблюдался низкий впадение пуповины. Почки плода были расположены в норме, без структурных изменений. Другие патологии органов не обнаружены.
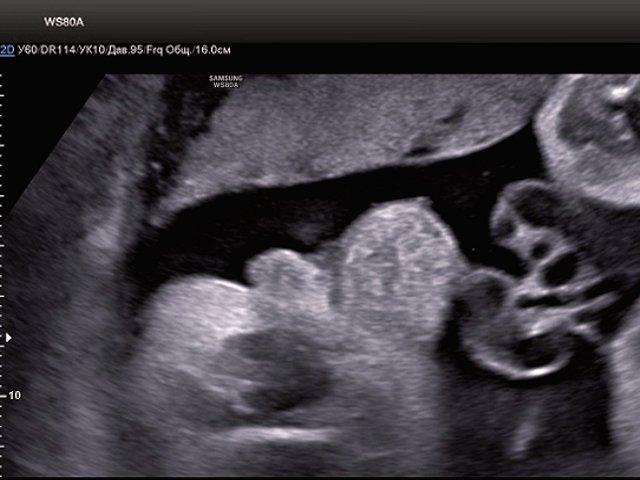
Рис. 1. Эхогенное образование в нижней части передней брюшной стенки (экстрофированный мочевой пузырь).
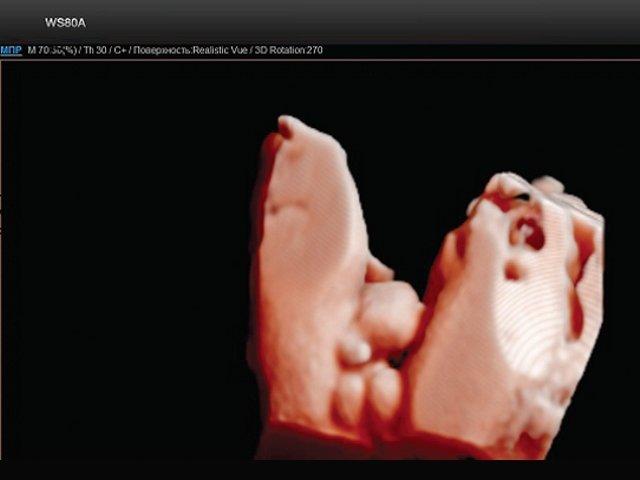
Экстрофия мочевого пузыря
Рис. 2. Экстрофия мочевого пузыря с отсутствием видимой патологии наружных половых органов (трехмерная реконструкция).
Был установлен диагноз: «Беременность 34,4 нед. ВПР плода — экстрофия мочевого пузыря».
Обсуждение
Пренатальные ультразвуковые признаки экстрофии мочевого пузыря включают: отсутствие визуализации мочевого пузыря при нормальном количестве околоплодных вод, структурно нормальные почки, наличие эхогенного образования в надлобковой области и аномалии половых органов. Использование цветного допплеровского картирования может служить дополнительным инструментом для диагностики экстрофии мочевого пузыря. В норме пупочные артерии идут вдоль стенки мочевого пузыря при поперечном сканировании. Для экстрофии мочевого пузыря характерно низкое впадение пуповины, когда артерии окружают эхогенное образование в надлобковой части. В случае отсутствия визуализации мочевого пузыря в характерном месте необходимо провести повторное сканирование через 30-40 минут для более точной оценки его положения и степени наполнения.
Изолированная экстрофия мочевого пузыря, как правило, не связана с хромосомными аномалиями плода и не требует проведения пренатального кариотипирования.
В данном клиническом случае экстрофия мочевого пузыря была диагностирована у плода женского пола, что встречается гораздо реже по сравнению с мужчинами. Кроме того, отсутствие выраженных деформаций наружных половых органов может свидетельствовать о неполной форме экстрофии. Оценка анатомического строения мочевого пузыря обязательна во всех триместрах беременности как часть скринингового обследования. Невизуализация мочевого пузыря в привычном месте должна вызывать настороженность у специалистов УЗ-диагностики. Тем не менее, экстрофию мочевого пузыря обычно выявляют лишь в третьем триместре беременности.
После появления на свет детям с экстрофией мочевого пузыря необходимо пройти через многоступенчатую и сложную хирургическую коррекцию. К сожалению, процент неудовлетворительных долгосрочных результатов по-прежнему остается высоким. Это часто связано с такими осложнениями, как нарушения в функционировании органов тазовой области, недержание мочи, рубцовое изменение половых органов, сексуальные дисфункции, значительная деформация передней брюшной стенки, уретерогидронефроз III-IV степени, постоянные рецидивирующие пиелонефриты с последующим снижением функции почек, хроническая почечная недостаточность и другими проблемами. Медико-социальная реабилитация таких пациентов остается значительной и сложной задачей.
Как обстоит дело с лечением экстрофии в РДКБ? Успешно ли оно?
Улучшение методов лечения экстрофии и внедрение собственных разработок позволили значительно повысить успешность наших результатов. Изучение работы различных хирургических школ дало возможность найти новые подходы к реконструкции, которые обеспечивают удержание мочи и самостоятельное мочеиспускание без необходимости периодической катетеризации. После завершения лечения у всех детей наблюдается способность удерживать мочу, и более 70% из них могут справляться с мочеиспусканием самостоятельно.
Качественное первичное закрытие мочевого пузыря критически важно для достижения хороших результатов в дальнейшем. Такой этап не обязательно должен проходить сразу после рождения, однако его должен выполнять опытный специалист. За восьмилетний период мы успешно провели первичное закрытие более 40 пациентам с экстрофией в возрасте от одного месяца до 15 лет.
Первичное закрытие мочевого пузыря: Когда и каким образом?
Первичное закрытие мочевого пузыря является важнейшим этапом в многоступенчатом лечении экстрофии. Родителям следует учесть несколько важных моментов, которые могут оказать значительное влияние на конечный результат.
Закрытие мочевого пузыря сразу после рождения сопряжено с риском осложнений от 20 до 80%. Эти осложнения у новорожденных могут быть связаны с тяжёлым состоянием, инфекциями в больнице, недостаточной иммунной защитой, попытками сжатия лонных костей, небольшими размерами мочевой пластинки, длительным пребыванием в стационаре (более 30 дней) и другими факторами. Кроме того, малыши часто находятся несколько дней в реанимации и на вытяжении, под мочевыми дренажами, что может привести к воспалениям, затруднить уход за ними, а также нарушить контакт с матерью и грудное вскармливание.
Считается, что сжатие лонных костей у новорожденных может улучшить результаты закрытия. Однако на практике наблюдается обратная картина — количество осложнений повышается после проведения этой процедуры в первые дни жизни. Операции на костях и сжатие лонных костей значительно ухудшают состояние ребенка, замедляют выздоровление и повышают вероятность инфекций. Нередко, даже после всех усилий, кости расходятся вновь на 5-7 см, что ставит под сомнение необходимость этих манипуляций.
Наилучшие результаты первичного закрытия достигаются у детей в возрасте от одного до трех месяцев. Операции, проведенные в промежутке с 6 до 14 месяцев, могут приводить к недоразвитию мочевого пузыря. Правильный уход за мочевой пластинкой после рождения имеет критически важное значение для успеха лечения. В течение месяца после рождения ребенок восстанавливается, устанавливает крепкую связь с матерью, а грудное вскармливание помогает сформировать иммунитет, и кишечная флора приходит в норму.
По моему опыту, операции по закрытию мочевого пузыря, выполненные в возрасте от 1 до 3 месяцев, обычно не требуют остеотомии и обеспечивают отличные результаты. Заживление происходит в течение 10-12 дней, после чего ребенка можно выписать домой, не создавая риска для развития инфекций, связанных с госпитализацией.
Остеотомия во время закрытия требуется лишь в 10-15% случаев, в основном у детей с экстрофией клоаки или при сильно увеличенной мочевой пластинке (более 5 см в диаметре). В случаях значительного расхождения лонных костей остеотомии, а также пластика полового члена могут быть выполнены в более старшем возрасте, когда ребенок уже справляется с недержанием мочи. Результаты фаллопластики при отсутствии недержания могут оказаться даже более удачными, чем у мальчиков в возрасте 1-2 лет.
Для детей полутора месяцев с небольшой мочепузырной пластинкой (менее 3 см) для достижения наилучшего результата может быть рекомендовано проведение обкалывания пузыря ботоксом (лантоксом или аналогом) сразу после рождения или в возрасте 1-2 месяцев, а уже через 4 месяца — выполнение операции. За этот Zeitraum поперечный размер пузырной пластинки увеличивается примерно в 1,5 раза, что значительно увеличивает шансы на успешное лечение.